今天是个特殊的日子,公司新招录的员工考核工作顺利结束,给为期近3个月的新员工培训工作画上一个圆满的句号。这也让我能够腾出手来继续投入到医疗器械生物相容性评价的研究工作中去。
今天,想跟大家一起"聆听"化学和材料表征对医疗器械的重要性。
目前,使用化学和材料表征协助评估医疗器械的生物相容性越来越受到重视,但对于医疗器械从业者来说,为什么化学和材料表征如此重要以及为什么它是医疗器械生物评价的重要组成部分可能并不明确,ISO系列的协调标准将这两者有效联系在一起并于ISO10993-1, ISO10993-18 and ISO10993-19中明确给出了答案。
1.医疗器械为什么会产生不良反应?
医疗器械材料造成的不良反应通常是由材料成分、污染物或分解产物从器械进入患者体内产生的化学效应,从而造成相应的生物效应。
生物材料一般是由化学物质的混合物组成的聚合物,其中一些化学物质与聚合物主链结合或进入材料基质,而其他化学物质则自由迁移到周围环境中,迁移到周伟环境的这些化学物质的特性和丰度决定了材料的生物相容性。
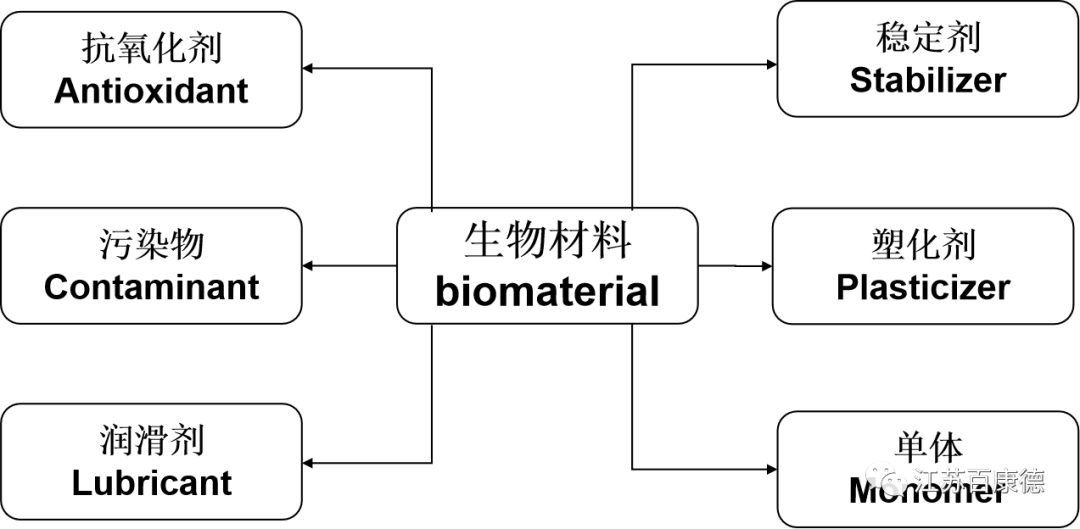
图1 从聚合物中迁移到周围环境的各种化学物质
2.为什么化学和材料表征是必需的?
化学常被称为中心科学,因为它在连接物理科学与生命科学、应用科学(如医学和工程学)方面起了纽带的作用。建立医疗器械及其材料的生物相容性是保证产品安全的关键,生物相容性的核心问题是化学和材料特性,了解这种材料的组成及其物理化学性质对于后续的评估至关重要。除了安全的问题,另一个重要的考虑因素是产品或材料均具有特定的属性以执行其预期的功能。为了评估这两方面的根本性问题,我们必须了解材料的化学成分以及化学成分和添加剂迁移或浸出到患者体液或组织中的能力,我们也有必要对拟用于制造和生产医疗设备的材料进行化学和材料特性的表征。
明确医疗器械材料的特性是ISO10993-1要求的全面进行生物学评价的第一步。由于材料和化学特性对生物评价的重要性,ISO10993-18被开发为一个单独的标准,该标准涵盖了提供有关材料和器械的化学成分、可浸出物的潜在释放以及器械可预测的生物学特性的基本要求。ISO10993-19标准将涉及材料和最终器械的物理、机械和形态特性。
为了解决安全性和功能两个基本问题,我们需要化学表征来评估潜在的可浸出化学品及其生物利用度,而机械/物理表征将解决功能和安全性问题,形态学表征将检查材料的表面,以努力解释或预测材料在器械-宿主(组织)界面上的相互作用。
3.风险管理和化学表征有什么联系?
随着ISO 10993-1的改版和变化,风险管理评估过程中的化学和材料特性更加受到重视,已经成为每个医疗器械开发和整体评估的一部分。任何材料或医疗器械的生物评价应当按照整个医疗器械行业风险管理文件ISO14971的要求,在风险管理过程中引入生物学评价方案作为整个风险评估的一部分。很明显,国际上确保生物安全的重点必须从化学和材料特性以及ISO10993-1、ISO10993-18, ISO10993-17和ISO14971规定的毒理学风险评估开始。这些ISO标准中提出的评估过程将有助于研发和生产企业选择最佳材料,并在器械的整个使用寿命期内控制这些材料的一致性。如果采取适当的措施,尽量减少关键的控制因素,体外材料检测通常可以准确地预测临床结果。
ISO10993-1从09版开始就着重强调化学和材料特性的必要性和重要性以确保产品或者材料的生物相容性。这种对医疗器械安全的高度认识已经具有国际通识,这在很大程度上是由于FDA法规和ISO标准的趋同。ISO10993系列标准要求在开始任何生物测试之前需要进行毒理学风险评估、化学和材料表征,该过程结合了对所有来源的现有数据的审查和评价,并在必要时选择和应用额外的测试。
4. 化学和材料表征工作从哪里开始?
化学和材料表征的目标是识别和量化化学成分和物理机械性能,以帮助建立材料的生物安全性。化学和材料表征是理解医疗器械材料的组成及其在器械投入临床使用时可能产生的不良生物效应的基础。材料选择和风险分析是医疗器械设计过程中不可或缺的组成部分,在评估生物安全性方面发挥着关键作用。与试验同样重要的是,生物安全评价计划的设计和实施应证明达到了特定的安全标准。
4.1. 器械或者材料的生物安全风险评估。生物安全评价作为风险管理的一部分,包括识别所有危害和估计相关风险,危险识别的一个主要组成部分是材料特性。可以根据以下步骤开展:
• 定义和描述每种材料,包括合适的替代材料;
• 识别材料、添加剂、加工和清洁助剂等的危害;
• 估计暴露量(总量或临床可用量);
• 审查毒理学和其他生物安全数据(已发表和可获得的数据)。
4.1.1. 鉴定制造医疗器械的材料的成分,对该器械的固有毒性进行调研。用于制造医疗器械的材料或加工助剂的任何成分都具有潜在的生物可利用性。然而,为了估计发生这种情况的风险,有必要获得证明这些化学成分在预期使用期间的可用程度的信息。这可以通过对器械或材料的提取试验来估计。如果不进行这些测试,同时需要确定使用该材料或制造过程中可能产生的任何生物危害,并假设使用的化学品数量完全可供患者使用,这样就可以从最坏情况的角度估计剂量-反应效应。
4.1.2. 危害和相关风险分析。风险分析即识别特定危害并评估其重要性的过程,从识别和表征与患者接触的材料和器械组件开始。我们首先要评估材料的物理和化学特性、临床使用历史或人体暴露数据,以及产品和成分材料、分解产物和代谢物的任何现有毒理学和其他生物安全数据。为了支持生物安全,应对已加工的样品进行材料测试,包括灭菌后的产品,以与最终器械中包含的材料相同的方式。
4.2. 确定后续动物试验测试项目
只有在确定了所有替代方案(审查先前知识、化学表征、体外评估)之后,才应考虑进行动物试验以进行风险评估。
声明:本文参考了一些国际先进文献的观点。