过去二十年,随着人们对癌症免疫学和免疫疗法的了解不断加深,治疗癌症的新方法空前增多。其中免疫细胞疗法这一范例已经变为现实。
本文作者/Elisa Cappuzzello博士等,原题How can Cytokine-induced killer cells overcome CAR-T cell limits,原载于Sec. Cancer Immunity and Immunotherapy,原文为英文干细胞与外泌体专家团队编译如下:
细胞因子诱导杀伤细胞(CIK)如何克服CAR-T细胞的限制
嵌合抗原受体 (CAR)-T 细胞成功治疗 B 细胞恶性肿瘤患者代表了过继细胞疗法 (ACT) 领域的突破。然而,CAR-T 疗法并非每个患者的选择,并且仍有几个需求未得到满足。特别是,CAR-T 细胞的生产成本高昂、劳动密集且在后勤方面具有挑战性。
此外,CAR-T 细胞输注引起的毒性,例如细胞因子释放综合征 (CRS) 和免疫效应细胞相关神经毒性综合征 (ICANS),已被广泛记录。替代细胞疗法产品,例如细胞因子诱导的杀伤 (CIK) 细胞,有可能克服其中的一些障碍。
CIK细胞最大的潜力在于其在同种异体环境中诱导移植物抗宿主病 (GvHD) 反应的能力非常有限。CIK 细胞的生产采用了一种简单且极其有效的扩增方案,这可导致效应细胞的大量扩增,并且与 CAR-T 细胞相比,所需的财务投入较低。
事实上,CAR-T 制造涉及在集中制造设施中使用昂贵的 GMP 级病毒载体进行工程设计,而CIK细胞的生产则可在当地GMP洁净设施中成功完成,并且 CIK 细胞治疗现已在许多国家获得许可。
此外,接受 CIK 细胞治疗的患者不会出现 CAR-T 细胞所观察到的毒性,从而进一步降低了患者住院和输注后监测的相关费用,并最终鼓励在医院或门诊环境中进行细胞治疗。
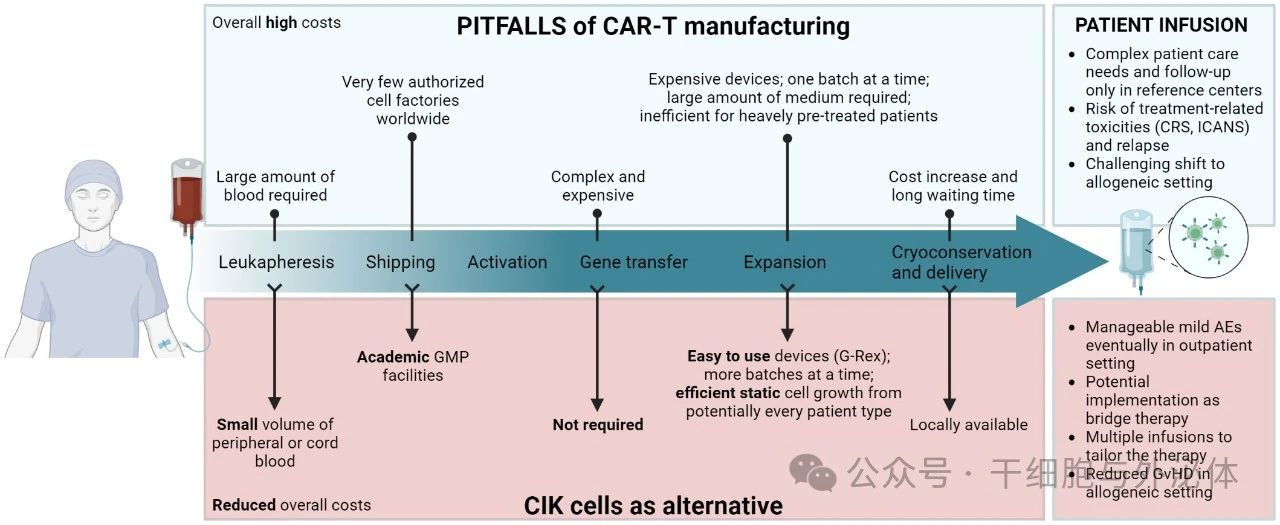
图:CAR-T 细胞疗法在制造和患者输注的每个步骤中的主要限制示意图(上图),以及使用 CIK 细胞如何克服这些缺陷(下图)。
CIK细胞来源的显著优势
与其他细胞治疗产品相比,CIK 细胞最显著的特征之一是其在同种异体环境中诱发移植物抗宿主病(GVHD)的能力非常有限,这一点已由多项使用 HLA 匹配、半相合或不匹配 CIK 细胞治疗患者的临床试验证实。
意大利科学家在首次发表的同种异体 CIK 细胞 I 期研究中,输注供体来源的 CIK 细胞在半数患者中显示出一定的临床活性,aGvHD 从未超过 2 级,在后续研究中发生率甚至更低 。
此外,人们已从脐带血 (UCB) 中分离出 CIK 细胞并进行临床测试,由于免疫原性较低,脐带血是异体免疫治疗细胞扩增的最佳起始材料;因此,可以容忍接受者和供者之间更高程度的 HLA 错配。通过冷冻保存离体扩增的脐带血细胞,脐带血还有可能提供“现成的”产品。
多项研究表明,CIK 细胞可从少量新鲜采集的脐带血(10-15 毫升)中有效扩增,甚至可以从用于脐带血移植的袋子冲洗液中扩增。脐带血衍生的 CIK 细胞表现出与外周血对应物相当的表型和抗肿瘤活性。从极小比例的总有核细胞开始,有可能扩增出足够的细胞,通过多次输注 CIK 细胞来治疗患者。
细胞因子诱导杀伤 (CIK) 细胞被证明非常有前景
1999 年,德国开展了第一项使用 CIK 细胞的 I 期临床试验,通过输注 IL-2 基因改造的 CIK 细胞治疗 10 名转移性肾癌、结直肠癌和淋巴瘤患者。临床结果显示,6 名患者病情进展,3 名患者治疗后无变化,1 名淋巴瘤患者完全缓解。作者指出,这一结果对于化疗耐药性和进行性转移性疾病患者来说是令人欣慰的。
除了 3 名患者出现 2 级发热并在第二天自行缓解外,未报告其他不良事件 (AE)。这项开创性研究为进一步研究 CIK 细胞疗法的潜力铺平了道路。事实上,CIK 细胞卓越的安全性和治疗效果已在许多不同的临床环境中得到广泛证实,严重移植物抗宿主病 (GvHD) 发生率低是这种细胞疗法的主要优势。
全球基于CIK细胞免疫治疗的临床试验
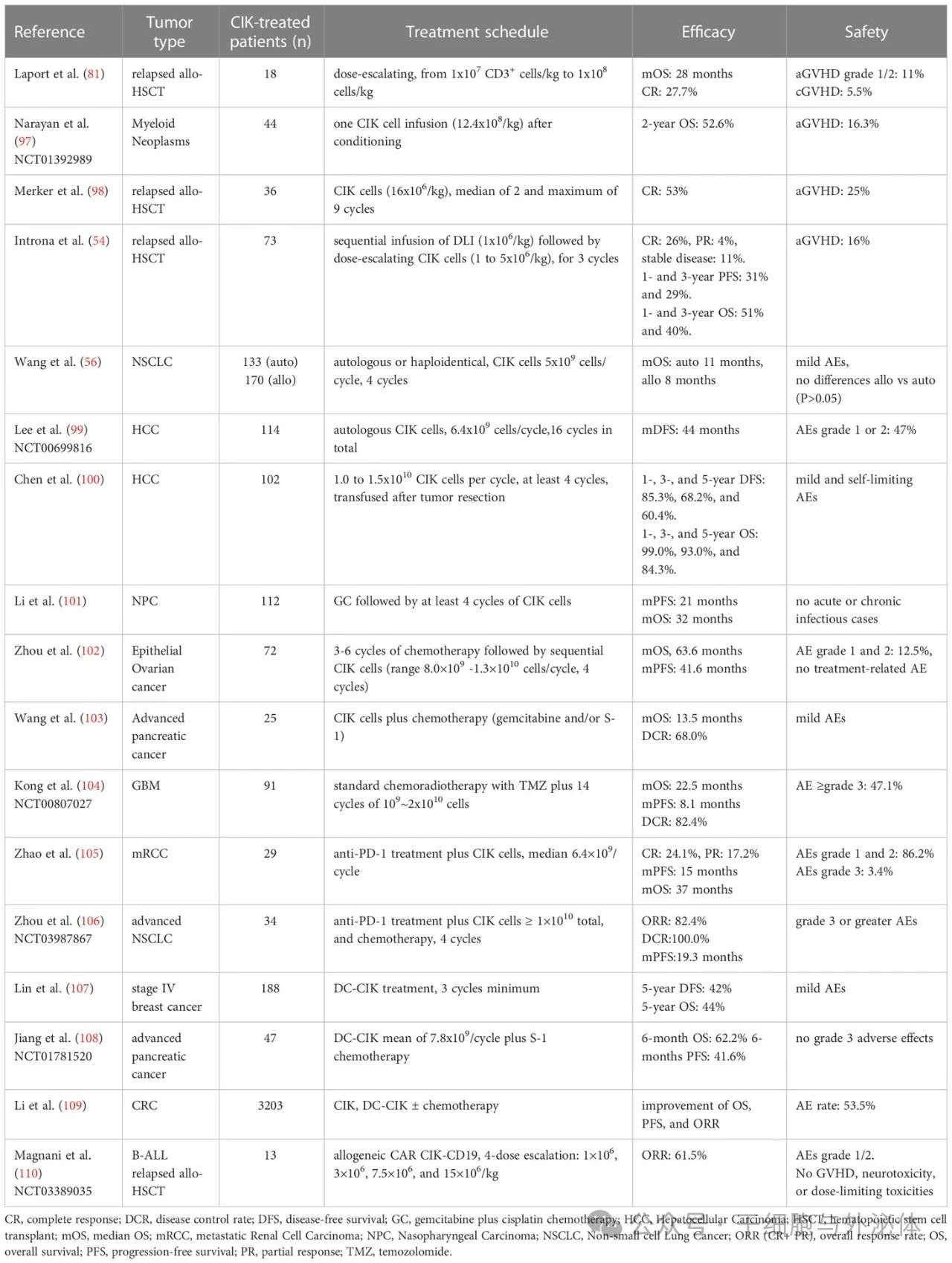
2010年,国际 CIK 细胞注册中心 (IRCC,www.cik-info.org ) 成立,旨在收集有关 CIK 细胞临床试验的详尽信息并尝试标准化 CIK 细胞治疗。2022年的报告总结了 106 项临床试验的结果,共招募了 10,225 名患者,其中 4,889 名(47.8%)单独接受 CIK 细胞疗法治疗或与其他常规或新型治疗策略联合治疗。
这些试验涵盖了30多种癌症。大多数研究报告称,中位无进展生存期(mPFS)和中位总生存期(mOS)显著改善。此外,有 10 项研究报告 1 年生存率显著提高,有 9 项研究报告 5 年生存率显著提高,凸显了 CIK 细胞治疗的治疗效果。
CIK细胞治疗血液系统恶性肿瘤
同种异体造血干细胞移植 (allo-HSCT) 是治疗血液系统恶性肿瘤患者的一种治疗方法,但复发仍然是治疗失败的主要原因之一。诱导复发后缓解的策略包括淋巴细胞输注(DLI) ,但这通常会诱发aGvHD,进而导致治疗失败。
斯坦福大学医学院一项 I 期剂量递增试验表明,在复发的 allo-HSCT 环境中可以安全地使用 CIK 细胞,并且 aGvHD 发生率较低。事实上,在 18 名患者中,有 2 名患者出现了 1 级或 2 级 aGvHD,5 名患者在 CIK 输注后达到或维持完全缓解(CR)超过一年。
此外,在 2019 年,同一小组提出将 CIK 细胞作为移植后早期巩固治疗。他们表明,这种治疗方案耐受性良好,具有抗肿瘤活性,并促进早期供体嵌合,而不会显著影响 44 名患者(NCT01392989)队列中的 aGvHD 发生率。事实上,与低肿瘤负担患者的供体淋巴细胞输注(DLI)治疗相比,CIK 细胞疗法显示出相似甚至更好的移植物抗白血病 (GVL) 效应,并观察到同种异体 HSCT 后 6 个月累积复发率 (CIR) 显著降低。
CIK细胞在实体肿瘤患者中的应用
CIK 细胞已在多项招募实体肿瘤患者的临床试验中证明了其安全性和有效性。根据 IRCC 报告,大多数 CIK 细胞研究调查的肿瘤实体是肺癌(26.4%)、肝细胞癌 (HCC, 18.9%)、肾细胞癌 (RCC, 15.1%) 和淋巴瘤 (15%) 。
中国医科大学附属第四医院的一项研究中,非小细胞肺癌 (NSCLC) 患者在不同阶段分别接受自体或同种异体 CIK 细胞治疗,结果发现治疗组和对照组的 AE 没有显著差异,mOS 分别为 11 个月和 8 个月。
此外,在一项针对 114 名 HCC 患者的多中心、随机、开放标签 III 期临床试验 (NCT00699816) 中,临床观察发现,与未接受任何 CIK 细胞输注的对照组相比,CIK 细胞治疗可使中位无病生存期 (mDFS) 延长 14 个月(44 个月 vs 30 个月)。CIK 细胞免疫疗法降低了所有类型的肿瘤复发,而且报告的不良反应为轻度至中度(1 级或 2 级)。
中山大学肿瘤防治中心的临床研究人员对 102 例根治性切除术后接受 CIK 治疗的患者的回顾性研究也证实了 CIK 细胞对转移性鼻咽癌(HCC) 的治疗效果,并观察到生存率显著提高。具体而言,1 年、3 年和 5 年无病生存率 (DFS) 分别为 85.3%、68.2% 和 60.4%,CIK 组与对照组之间的差异不显著(P=0.055)。此外,CIK 组的总生存期显著高于对照组,这证明了 CIK 细胞治疗的有效性。
CIK细胞联合疗法
CIK 细胞治疗的低毒性和高可行性促进了新型联合疗法的研究,与单一疗法相比,其疗效更佳。
中山大学肿瘤防治中心一项回顾性研究探讨了 CIK 细胞联合化疗治疗转移性鼻咽癌 (NPC) 的效果,共纳入 222 例患者,其中 112 例接受吉西他滨加顺铂 (GC) 方案化疗,随后接受至少 4 个周期的 CIK 免疫治疗。在 3 年的随访中,GC 联合 CIK 治疗组的生存率明显高于单纯 GC 组(mPFS 21 个月 vs 15 个月;mOS 32 个月 vs 23 个月),提示 CIK 辅助免疫治疗可有效维持晚期转移性鼻咽癌患者的病情稳定并延长生存期。
同样,接受 CIK 细胞联合化疗方案治疗的卵巢癌患者的总生存期和无进展生存时间也明显优于仅接受化疗的对照组(mOS,63.6 vs 39.6 个月,mPFS,41.6 vs 26.1 个月)
郑州大学附属肿瘤医院的团队研究显示,晚期胰腺癌患者接受CIK细胞联合吉西他滨和/或口服化疗药S-1治疗后,疾病控制率(DCR)(68.0%)较对照化疗组(29.8%)有显著提高。
韩国首尔高丽大学医学院在一项共 180 例初诊胶质母细胞瘤患者的多中心 III 期临床试验中,自体 CIK 细胞输注联合标准放疗‐替莫唑胺放化疗使 CIK 组的无进展生存时间显著延长至 8.1 个月,而对照组为 5.8 个月。两组间 3 级或以上不良事件、健康相关生活质量和体能状态无差异。
抗 PD-1 抗体免疫疗法正在彻底改变许多癌症的治疗方法;然而,许多患者对 PD-1/PD-L1 抑制剂没有肿瘤反应,部分原因是肿瘤内 T 细胞浸润不足。CIK 细胞可以选择性地浸润肿瘤组织并分泌 INF-γ ,从而诱导局部炎症微环境并最终实现抗 PD-1 疗法的有效性。在转移性肾细胞癌(RCC)和非小细胞肺癌(NSCLC)患者中研究了 CIK 细胞联合抗 PD-1 疗法的疗效,中位无进展生存期 (mPFS) 分别为 15 个月和 19.3 个月。
CAR-CIK细胞治疗
CIK 细胞也被用作一种有前途的基因改造平台,其中 CAR 分子靶向 CD123 + /CD33 +急性髓细胞白血病 (AML) 、CD19 +急性淋巴细胞白血病 (ALL) 、ErbB2 +横纹肌肉瘤 (RMS) 、CSPG4 +和 CD44v6 +软组织肉瘤 (STS),与未转导的 CIK 细胞相比,显示出更高的细胞毒性。CAR 修饰的 CIK 细胞将通过内在 NKG2D 介导和 CAR 特异性靶向发挥抗肿瘤活性。
2020 年,意大利米兰大学的研究人员首次报道了在临床环境中使用 CAR 工程 CIK 细胞。这项多中心 I/II 期临床试验 (NCT03389035) 旨在评估在 HSCT 后复发的急性 B 淋巴细胞白血病 (B-ALL) 患者中输注同种异体 CARCIK-CD19 的安全性和可行性。4 名儿童患者和 9 名成人患者输注了单剂量 CAR-CIK 细胞。接受最高剂量的 7 名患者中有 6 名在第 28 天达到 CR 和 CR 但血细胞计数恢复不完全 (CRi)。仅在最高 CARCIK-CD19 剂量下才报告了 1 级和 2 级 CRS 毒性。令人印象深刻的是,没有观察到 GvHD、神经毒性或剂量限制性毒性。这项研究表明,即使用 CAR 分子修饰,CIK 细胞与 CAR-T 淋巴细胞相比也表现出更好的安全性。
总之,在细胞治疗领域,CAR-T 细胞的局限性为改进和开发其他治疗方案提供了机会。CIK 细胞可能是一种非常有吸引力的替代方案,因为它们可以使用一种非常简单、省时且经济高效的方法制造,这种方法几乎不需要技术干预,也无需使用昂贵的设备。