医疗器械研发(或叫设计开发)有八大过程和一大工具,即:策划、输入、输出、验证、确认、转换、更改、评审过程和风险管理工具,每个过程或阶段都有其具体需要开展的重要工作。本篇和大家一起探讨探讨设计开发验证过程的相关工作。
设计开发验证是指通过提供客观证据对规定要求已得到满足的认定过程,以确保设计和开发输出满足输入的要求,并保持验证结果和任何必要措施的记录。由此可见,验证主要是对输入的信息进行认定,从而使输出的内容满足输入的要求。
1验证方法
设计开发输入和输出的信息很多,不同的信息可以有不同的验证方法,从而导致验证方法也很多。常用验证方法有:(1)对设计的数据或要求采取不同的方法进行计算和验证;(2)与类似设计进行比较;(3)制作样机试验和演示(如稳定性);(4)产品检验,分为全项目自检、部分项目自检+部分项目委托检验、全项目委托检验3种情形;(5)由有经验的人员或专家对设计和开发文件进行评审。注意,评审也是验证方法之一,如输出图纸的评审。
其中产品检验是最常用的方法之一,而最常见的就是我们常说的注册检验或型式检验。
需注意的是,对于全项目自检和部分项目自检+部分项目委托检验的情形,要满足《医疗器械注册自检管理规定》,对人机料法环各方面都有比较高的要求。对于全项目委托检验的情形,需要有资质的医疗器械检验机构出具的检验报告。
产品技术要求完全采用国家标准和行业标准的,检验机构必须取得该国家标准和行业标准的资质认定,报告封面加盖资质认定标志CMA章,并在报告备注中注明。产品技术要求不涉及或部分涉及国家标准和行业标准进行检验并出具报告的,应在检验报告书备注中对承检能力予以自我声明,并承担相应的法律责任。自我声明内容为“该产品技术要求不涉及/部分涉及国家标准、行业标准,不能直接作为资质认定许可的依据,但本实验室对报告涉及的检验项目具备相应的承检能力”。
2验证内容
由于注册检主要是检测产品技术要求上的产品性能项目,而设计开发输出还有很多其他没有列入技术要求里的内容,也需要进行验证,比如咱们输出的图纸、工艺规程、生产条件、产品有效期等都需要验证。
不同类型的医疗器械输出内容差异很大,比如无菌医疗器械的和非无菌提供的不一样,新产品和改进产品也不一样,带软件的器械还需要进行软件验证等等,导致不同医疗器械的验证工作量和耗费时间差异很大。咱们以常见的无菌医疗器械(无源)为例,从“人”“机”“料”“法”“环”等方面一起探讨所需的验证工作。
2.1“人”
人员及洁净服。包括人员的净化效果,人手的初始污染菌,洁净服的清洗消毒效果以及所用消毒剂的验证。
2.2“机”
设备和工装。生产和检验的关键设备的验证,设备工装工具的清洁验证。
2.3“料”
物料和产品。物料及产品初始污染菌和微粒验证,物料及产品的清洗验证,物料和产品及自配试剂的有效期验证。
产品有效期验证可以通过实时老化实验或加速老化实验进行,以实时老化实验结果为准。还应注意的是,有效期验证应考虑产品运输条件的影响,一般是将老化实验和运输验证结合起来一起进行,即先进行运输验证,再进行老化实验。
2.4“法”
指生产过程中所需遵循的规章制度,包括:工艺指导书,标准工序指引,生产图纸,生产计划表,产品作业标准,检验标准,各种操作规程等。
一般来说,图纸可以通过评审的方式进行验证,即评价输出的图纸是否满足了输入的产品结构要求等。
设计开发验证里的工艺验证包括关键工艺验证和特殊过程确认。通过合理采用验证批次、样本量、工艺参数、操作过程等因素,对生产工艺进行评价,以保证能稳定生产出合格产品。
2.4.1关键工艺验证
关键工艺验证持续整个医疗器械生产过程,一般采用前验证的方式进行,而且定期需要进行再验证。
对于连续的多个工序,可以采用两种验证方法。
一种是每个批次都完成产品生产的整个工艺过程,对每个关键工序取样检测并监控生产设备参数,产品的检测参数或者生产设备的参数在固定范围内,如果工艺稳定可靠,进行工艺验证的多个批次(一般为三个批次)多个工序抽取的产品或监控都参数都在比较稳定的合格数值范围内。比如灌装生产包括混液和灌封工艺,可以连续灌装三个批次,每个批次在混液和灌封工艺点取样评价,如结果合格则既评价了整个灌装工艺过程,也对混液和灌封工艺进行了验证。
另一种验证方法是每个关键工序单独验证,都验证合格后再按照验证参数连续生产,检测连续生产产品的质量,以评价整个工艺过程稳定性。比如球扩型药物洗脱支架生产整个工艺过程包括支架切割-药物喷涂-压握等关键工艺,在工艺验证的时候可以先单独进行每一个工艺验证。准备三个批次的待加工样品,先做支架切割工艺验证;验证合格后,将这三个批次样品进行药物喷涂的工艺验证;验证合格后,再将这三个批次的载药支架样品进行与球囊导管的压握工艺验证。三个关键工艺验证完成后,再按照验证参数连续生产,并检测产品质量以验证整个工艺过程稳定性。
2.4.2特殊过程确认
特殊过程确认一般包括安装鉴定(IQ)、运行鉴定(OQ)、性能鉴定(PQ),常见的特殊过程确认项目包括:(1)焊接确认;(2)塑料注塑成型(3)清洗确认;(4)无菌包装封口过程确认;(5)灭菌过程确认;(6)解析过程确认;(7)包装运输过程模拟确认。
2.5“环”
洁净室环境验证、制水系统验证、压缩空气系统验证等。
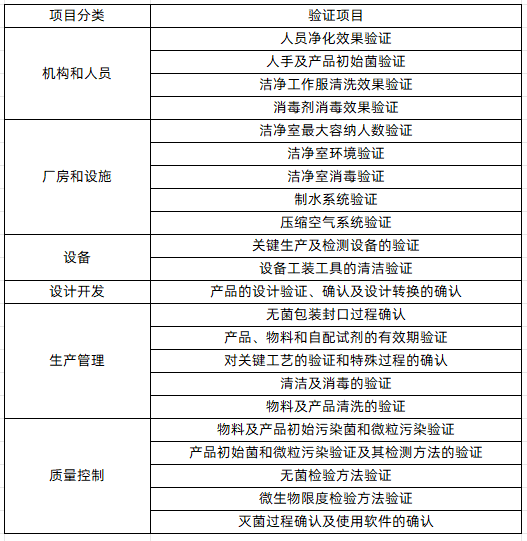
按照GMP顺序,无菌医疗器械生产需做的验证和确认项目整理如下表所示。
无菌医械生产所需的验证
3验证流程
不同的设计验证,其过程会有所不一样,但一般来说,主要包括如下步骤:确定验证目的-明确验证方式-制定验证方案-实施验证工作-形成验证报告。
3.1确定验证目的
首先要确定具体的验证目的,比如图纸评审的是验证产品结构和输入信息吻合,工艺验证的目的是验证生产工艺的稳定性,性能验证的目的是评价产品的性能符合设计输入的指标,而灭菌验证是验证灭菌工艺的稳定性和最终灭菌效果符合要求。
3.2明确验证方式
确定了验证目的就要明确验证方式,即采取什么方法进行验证。医疗器械验证方式主要有前验证、同步验证、回顾性验证和再验证四种。根据产品和验证目的不同,选择不同的验证方式。
验证灭菌效果和工艺变更,可选择前验证(即先实施验证再进行工艺操作);在取样规定较为完善,生产和工艺条件监控比较好的情况下,可选用同步验证;在更换设备、出现系统性偏差时,则应当进行再验证;对于产品质量指标稳定性验证等方面,可以选择回顾性验证。
3.3制定验证方案
验证工作涉及部门较多,包括研发、生产、质检、采购等都会参与,故需成立验证小组,明确验证小组人员和职责、时间安排、验证方法和样本量、验证数据收集方式、验证结论判断标准等信息。
验证方案制定后需经过相关评审批准后才能予以实施。验证方案是验证工作的纲领性文件,体现了整个验证的思路和方法,决定验证效果,故需认真准备。
3.4实施验证工作
验证小组成员要严格执行验证方案,注意验证工作中的细节,还应重视验证过程中的实时情况,可以视其与方案的偏离程度决定是否调整。调整验证方案一定要通过验证小组评审批准后才能继续实施。
3.5形成验证报告
验证工作完成后,应当对验证数据进行分析,评价验证结果,以形成验证报告。验证报告须经相关部门人员审阅,签批后方可生效。此外,如果验证出现了与预期不一致的结果,需要结合验证中具体情况进行分析,辨明原因,变更验证方案,重新进行验证工作。